বিরল ভূমিজ ধাতু এবং চুম্বক
বিশ্ব জুড়ে এখন আলোচনার একটি গুরুত্বপূর্ণ বিষয় হল বিরল ভূমিজ মৌল বা Rare Earth Elements এবং বিরল ভূমিজ চুম্বক, অর্থাৎ Rare Earth Magnets। এই চর্চার কারণ উদ্ভুত হয়েছে প্রধানত রাজনৈতিক ও অর্থনৈতিক সঙ্কটের পরিপ্রেক্ষিতে। শিল্পজগতে এই ধরণের চুম্বকের ব্যবহার অতি ব্যাপক। কিন্তু এই মৌলগুলির, এবং তারপর চুম্বকগুলির, উৎপাদনের সিংহভাগ এই সময়ে চিনের নিয়ন্ত্রণে। আর বিশ্ব রাজনীতির দাবা খেলার ফসলস্বরূপ এই পদার্থগুলির যোগান-চাহিদার সমতা এখন বিপর্যস্ত।
কিন্তু এই নিবন্ধের বিষয়বস্তু এই পদার্থগুলি নিয়ে, এর জটিল রাজনীতি নিয়ে নয়।
বিরল ভূমিজ মৌল (Rare Earth Elements) কোনগুলি?
 পর্যায় সারণীর বিষয় তো আমরা জানি। মৌলিক পদার্থের পারমাণবিক সংখ্যা বা atomic number-এর ভিত্তিতে সব মৌলদের স্তম্ভে এবং সারিতে সাজানো হয়েছে এই সারণীতে।
পর্যায় সারণীর বিষয় তো আমরা জানি। মৌলিক পদার্থের পারমাণবিক সংখ্যা বা atomic number-এর ভিত্তিতে সব মৌলদের স্তম্ভে এবং সারিতে সাজানো হয়েছে এই সারণীতে। 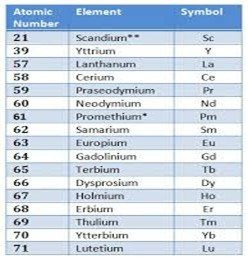 এর ষষ্ঠ এবং সপ্তম সারি দুটির দৈর্ঘ্য একটু বেশি। সারণীকে সুষ্ঠুভাবে শ্রেণীবদ্ধ এবং বোধগম্য করার প্রয়োজনে এই দুই সারির সমবৈশিষ্ঠ্যের কয়েকটি মৌলিক পদার্থকে আবার আলাদা করে নীচে দুটি পৃথক সারিতে দেখানো হয়। এই উপসারির প্রথমটিতে আছে ১৫টি মৌল, যাদের পারমাণবিক সংখ্যা পর্যায়ক্রমে ৫৭ থেকে ৭১। এই শ্রেণীর মৌলিক পদার্থদের বলা হয় ল্যান্থানাইড (lanthanides)। এদের সঙ্গে আরো দুটি মৌল, যাদের পারমাণবিক সংখ্যা যথাক্রমে ২১ এবং ৩৯, তারাও তুলনামূলক বৈশিষ্ট্য প্রদর্শন করে। এই মোট ১৭টি মৌলিক পদার্থকে বিরল ভূমিজ মৌল বলে চিহ্নিত করা হয়েছে।
এর ষষ্ঠ এবং সপ্তম সারি দুটির দৈর্ঘ্য একটু বেশি। সারণীকে সুষ্ঠুভাবে শ্রেণীবদ্ধ এবং বোধগম্য করার প্রয়োজনে এই দুই সারির সমবৈশিষ্ঠ্যের কয়েকটি মৌলিক পদার্থকে আবার আলাদা করে নীচে দুটি পৃথক সারিতে দেখানো হয়। এই উপসারির প্রথমটিতে আছে ১৫টি মৌল, যাদের পারমাণবিক সংখ্যা পর্যায়ক্রমে ৫৭ থেকে ৭১। এই শ্রেণীর মৌলিক পদার্থদের বলা হয় ল্যান্থানাইড (lanthanides)। এদের সঙ্গে আরো দুটি মৌল, যাদের পারমাণবিক সংখ্যা যথাক্রমে ২১ এবং ৩৯, তারাও তুলনামূলক বৈশিষ্ট্য প্রদর্শন করে। এই মোট ১৭টি মৌলিক পদার্থকে বিরল ভূমিজ মৌল বলে চিহ্নিত করা হয়েছে।
বিরল মৌলিক পদার্থরা কি সত্যিই বিরল?
তা ঠিক নয়। বস্তুত সারা পৃথিবী জুড়েই বহু জায়গায় অন্য খনিজের সঙ্গে মিশ্রিত অবস্থায় এদের পাওয়া যায়।
তবে ‘বিরল’ শব্দ জুড়ে দেওয়া হল কেন ?
প্রধানত দুটি কারণে। প্রথমত, অন্য খনিজ পদার্থ, যেমন ধরা যাক কয়লা বা তামা, যেমন স্তরবদ্ধভাবে পাওয়া যায় এবং সহজেই সনাক্ত করা সম্ভব, এই মৌলগুলিকে তেমনভাবে পাওয়া যায় না, তাই চিহ্নিত করা কষ্টসাধ্য। আগেই বলেছি, এদের পাওয়া যায় অন্য খনিজ পদার্থের সঙ্গে মিশ্রিত অবস্থায়, ছড়িয়ে ছিটিয়ে, এবং এদের পরিমাণগত ভাগ খুবই কম, গড়ে মাত্র পাঁচ শতাংশ বা তারও কম। ধারণা করার জন্য একটা উদাহরণ দেওয়া যেতে পারে। সমগ্র আমেরিকা জুড়ে যদি খনিজ উদ্ধার করা যায়, তবে প্রতি কিলোগ্রাম খনিজ থেকে মাত্র ৩০০ মিলিগ্রামের মত এই বস্তুগুলি পাওয়া যেতে পারে। যত খনিজ মৌল আহরণ করা সম্ভব, প্রাপ্যতার মাপকাঠিতে তাদের মধ্যে এদের স্থান ৫০ পার্সেন্টাইল।
দ্বিতীয় কারণ, খনিজ আহরণের পর এই মৌলগুলিকে নিষ্কাশন (extraction) এবং পৃথকীকরণ (separation/refining) প্রক্রিয়া অত্যন্ত জটিল, কষ্টসাধ্য, ব্যায়সাপেক্ষ এবং সময়সাপেক্ষ। এগুলি রাসায়নিকভাবে খুবই সক্রিয় অর্থাৎ সহজেই অন্য মৌলিক পদার্থের সঙ্গে মিশে যৌগ গঠন করে, আর সেই সব যৌগগুলি আবার অতিশয় স্থায়ী, সহজে রাসায়নিক প্রক্রিয়ায় বা উত্তাপে ভাঙে না। যদি বা পৃথক করাও যায়, অবিলম্বেই পারিপার্শিক অক্সিজেনের সঙ্গে মিলিত হয়ে অক্সাইড গঠন করে। সেই জন্যই বেশির ভাগ ক্ষেত্রেই এই তথাকথিত বিরল মৌলগুলিকে তাদের অক্সাইড আকারে অথবা অন্য বিরল মৌলের সঙ্গে মিশ্রিত অবস্থায়ই বাজারজাত করা হয়।
কী কারণে এই ধাতুগুলি এত স্বতন্ত্র?
এদের বিশেষত্ব অনেক। সে প্রসঙ্গে যাবার আগে বুঝতে হবে, এই ধাতুগুলির পারমাণবিক গঠনই এমন যার জন্য এরা এই সব বিশেষ ধরণের ব্যবহার করে।
পরমাণুর ভেতরে থাকে ইলেকট্রন যারা কেন্দ্র বা nucleusকে প্রদক্ষিণ করছে। ইলেকট্রনরা নির্দিষ্ট স্তর বা shellএ অবস্থান করে। এই shellগুলির নামকরণ করা হয়েছে 1, 2, 3, 4 … বা K, L, M, N … ইত্যাদি। কোন shell ক’টি ইলেকট্রন ধারণ করতে পারে, তার সংখ্যাও নির্দিষ্ট। প্রথম shell Kতে থাকে দু’টি, তার পর L,M,N ধারণ করতে পারে যথাক্রমে সর্বাধিক ৮, ১৮ ও ৩২টি ইলেকট্রন। পরমাণুতে একটি করে ইলেকট্রন যোগ হওয়া মানে পর্যায় সারণীতে পরবর্তী মৌলের অবস্থান। এই সব ইলেকট্রনরা কিন্তু একই shellএর মধ্যে থেকেও ত্রিমাত্রিক ভাবে একই ঘূর্ণপথ পরিক্রমা করে না। তাই স্তরের মধ্যেও থাকে প্রতিস্তর বা subshell। আসলে যাকে স্তর বা প্রতিস্তর বলা হচ্ছে, সেগুলি হল বিভিন্ন শক্তিস্তর বা energy level। তো shellএর মধ্যে subshellগুলিকে চিহ্নিত করা হয়েছে s, p, d, f অক্ষরগুলি দিয়ে। এই subshellগুলিতে সর্বাধিক কতগুলি ইলেকট্রন থাকতে পারে, তার সংখ্যাও নির্দিষ্ট। s-প্রতিস্তরে ২টি, p-তে ৬টি, d-তে ১০টি এবং f-এ ১৪টি।
ওপরে যা আলোচনা করা হল, বোঝার সুবিধার্থে নীচের ছকটি তারই প্রতিকল্প: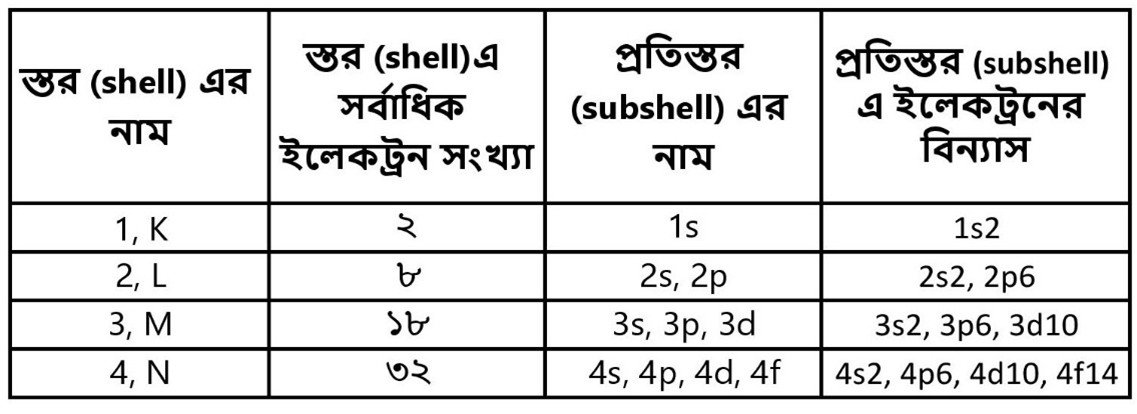
Subshell-এর মধ্যেও আবার ইলেকট্রনগুলির স্বীয় কক্ষপথ বা orbital থাকে। ওপরে চতুর্থ স্তম্ভে যে ইলেকট্রনের বিতরণ দেখানো হয়েছে, সেগুলির এক একটি স্বতন্ত্র orbital থাকে।
যে সব মৌল পদার্থে ইলেকট্রনের সংখ্যা বেশি, তাদের ইলেকট্রন প্রতিস্তরের কক্ষপথের শক্তিমাত্রা (energy) নির্ভর করে ইলেকট্রনগুলির পারস্পরিক সম্পর্কের ওপর। স্তরের এবং প্রতিস্তরের সংখ্যা যত বাড়ে, তাদের মধ্যে শক্তিমাত্রা বাড়ে ঠিকই, কিন্তু দুইই যখন বাড়ে, তখন পারস্পরিক শক্তিস্তরের পার্থক্য কমতে থাকে। নতুন ইলেকট্রন এসে নতুন মৌল তৈরি করতে গিয়ে কোন স্তরের কোন প্রতিস্তরে গিয়ে আশ্রয় নেবে তা নির্ভর করে এই শক্তিমাত্রার পার্থক্যের ওপর। পাশের ছবিতে ডান দিকে দেখানো হয়েছে কক্ষপথের মধ্যে শক্তিমাত্রার ক্রম। বাঁ দিকের চিত্রটি গুরুত্বপূর্ণ। এতে দেখানো হয়েছে ইলেকট্রন এসে কোন স্তরের কোন প্রতিস্তরে জায়গা করে নেবে, তার ক্রম। নীল তিরের পথ পরিক্রমা করলে তার হদিস পাওয়া যাবে। দেখা যাচ্ছে যে 3p orbitalএর পর 3d নয়, 4s orbital আগে ভর্তি হয়, এবং এই ভাবে চলতে থাকে।
কোয়ান্টামতত্ব বিজ্ঞানী উলফগ্যাঙ্গ পাউলি আবার একটি বর্জনসূত্র (Pauli’s Exclusion Principle) দিয়েছেন, যা মেনে চললে. কোন orbital-এ দু’টির বেশি ইলেকট্রন থাকতে পারে না, এবং সে দু’টি ইলেকট্রনের ঘূর্ণন বা spin হতে হবে বিপরীতমুখী। এদের বলা হয় জোড়বদ্ধ ইলেকট্ন (paired electrons)। অতএব এই আইন মেনে, এবং কক্ষপথে ইলেকট্রন ভর্তির ওপরে দেওয়া ক্রম অনুসরণ করলে, মৌলিক পদার্থের পরমাণুতে বেজোড় ইলেকট্রনের (unpaired electron) পরিস্থিতি আসতেই পারে।
কক্ষপথে ইলেকট্রন ভরনের যে সাধারণ ক্রম আমরা দেখলাম, ল্যান্থানাম থেকে শুরু করে বিরল ভূমিজ মৌলগুলির ক্ষেত্রে তার কিছু ব্যতিক্রম হয়। এই ধাতুগুলির পারমাণবিক সংখ্যা ৫৭ থেকে ৭১। এত ইলেকট্রন ভরতে গিয়ে, ওপরের নিয়ম মত 6s orbitalএর পর 4f, তারপর 5dতে ইলেকট্রন আসা উচিত। কার্যত ল্যান্থানামের ক্ষেত্রে কিন্তু আগে 5d এবং তারপর 4f-এ ইলেকট্রন আসে। তার কারণ এইরকম। পারমাণবিক সংখ্যা বৃদ্ধির ফলে নিউক্লিয়াসের বৈদ্যুতিক চার্জও বৃদ্ধি পায় এবং প্রশমিত অবস্থায় 4f orbital সঙ্কুচিত হয়, তার শক্তিমাত্রা কমে আসে।  কিন্তু তা সত্ত্বেও, প্রথম ল্যান্থানামের ক্ষেত্রেই, 5d orbital 4f-এর থেকেও আরও সামান্য কম শক্তিমাত্রায় অবস্থান করে। সেই জন্যই নতুন ইলেকট্রন এসে আগে 5dতে জায়গা করে, 4f-এ নয়। এই জন্য ল্যান্থানাম f-গোষ্ঠির রাসায়নিক বৈশিষ্ট্য প্রদর্শন করলেও আদতে আনুষ্ঠানিকভাবে d-গোষ্ঠিগত অবস্থানান্তর ধাতু (transition metal)। ল্যান্থানামের পরবর্তী মৌলগুলিতে আবার যথারীতি 4f orbital ভরতে শুরু করে। নীচে বিরল ভূমিজ ধাতুগুলির ইলেকট্রনগত গঠন দেওয়া হল। এখানে [Xe]-এর অর্থ এদের আগে পর্যন্ত পারমাণবিক সংখ্যা ৫৪-র মৌল xenon-এর গঠন ধরে নিতে হবে। লক্ষণীয় যে আপাতভাবে Eu ও Gd, এবং Yb ও Lu -এর গঠন একই মনে হতে পারে। 4f কক্ষপথ যখন অর্ধেক বা পুরোপুরি ভরাট হয় (৭ এবং ১৪ ইলেকট্রন) তখন তার স্থিরতা বাড়ে। এই জন্য ইলেকট্রন এই অবস্থানে আসতে অগ্রণী হয়। Gd এবং Lu এর ক্ষেত্রে নবাগত ইলেকট্রন 4f-এ এলেও তাদের পাউলি সাহেবের সুত্র মেনে বিপরীতমুখী ঘূর্ণন হতে হবে। স্থিতিশীল অবস্থায় সমান গঠন দেখালেও প্রতিক্রিয়ার ক্ষেত্রে এরা একে অপরের থেকে সামান্য ভিন্নধর্মী। এদের প্রোটন সংখ্যা আলাদা। তাই এরা ভিন্ন ধাতু।
কিন্তু তা সত্ত্বেও, প্রথম ল্যান্থানামের ক্ষেত্রেই, 5d orbital 4f-এর থেকেও আরও সামান্য কম শক্তিমাত্রায় অবস্থান করে। সেই জন্যই নতুন ইলেকট্রন এসে আগে 5dতে জায়গা করে, 4f-এ নয়। এই জন্য ল্যান্থানাম f-গোষ্ঠির রাসায়নিক বৈশিষ্ট্য প্রদর্শন করলেও আদতে আনুষ্ঠানিকভাবে d-গোষ্ঠিগত অবস্থানান্তর ধাতু (transition metal)। ল্যান্থানামের পরবর্তী মৌলগুলিতে আবার যথারীতি 4f orbital ভরতে শুরু করে। নীচে বিরল ভূমিজ ধাতুগুলির ইলেকট্রনগত গঠন দেওয়া হল। এখানে [Xe]-এর অর্থ এদের আগে পর্যন্ত পারমাণবিক সংখ্যা ৫৪-র মৌল xenon-এর গঠন ধরে নিতে হবে। লক্ষণীয় যে আপাতভাবে Eu ও Gd, এবং Yb ও Lu -এর গঠন একই মনে হতে পারে। 4f কক্ষপথ যখন অর্ধেক বা পুরোপুরি ভরাট হয় (৭ এবং ১৪ ইলেকট্রন) তখন তার স্থিরতা বাড়ে। এই জন্য ইলেকট্রন এই অবস্থানে আসতে অগ্রণী হয়। Gd এবং Lu এর ক্ষেত্রে নবাগত ইলেকট্রন 4f-এ এলেও তাদের পাউলি সাহেবের সুত্র মেনে বিপরীতমুখী ঘূর্ণন হতে হবে। স্থিতিশীল অবস্থায় সমান গঠন দেখালেও প্রতিক্রিয়ার ক্ষেত্রে এরা একে অপরের থেকে সামান্য ভিন্নধর্মী। এদের প্রোটন সংখ্যা আলাদা। তাই এরা ভিন্ন ধাতু।
এই 4f ইলেকট্রনদের নিউক্লিয়াসের নিকটবর্তী অবস্থান এবং ফলত জাড্য, বেজোড় ইলেকট্রনের উপস্থিতি, কাক্ষিক শক্তিমাত্রার বিভিন্নতা ইত্যাদি বিরল ভূমিজ ধাতুগুলিকে বহুবিধ বিচিত্র বৈশিষ্ট্যের অধিকারী করেছে।
বৈশিষ্ট্য এবং উপযোগিতা
সাধারণত এই ধাতুগুলির যোজ্যতা ৩ (trivalent) কারণ 6s ও 5d orbital থেকে সহজেই এরা ৩টি ইলেকট্রন বিনিময় করে। তবে সিরিয়াম এবং ইউরোপিয়াম ৪ এবং ২ যোজ্যতাও প্রদর্শন করে। ল্যান্থানাইডদের রাসায়নিক বৈশিষ্ট্য প্রায় সব একই রকম, সে জন্য একে অন্যের থেকে এদের পৃথক করাও কষ্টকর। বিশুদ্ধ অবস্থায় রুপোর মত চাকচিক্য থাকে, কিন্তু আবহাওয়ার সংস্পর্শে দ্রুত ঔজ্জ্বল্য হারায়। কারণ, আগেই বলেছি, এগুলি খুব সহজেই অক্সিজেনের সঙ্গে রাসায়নিক ক্রিয়ায় অক্সাইড গঠন করে। এরা সকলেই রাসায়নিকভাবে অতি সক্রিয় ধাতু।
ইলেকট্রন গঠনের জন্য এদের রাসায়নিক প্রক্রিয়ায় অনুঘটক (catalyst) হিসেবে ব্যবহার করা হয়। সিরিয়াম তেলচালিত গাড়িতে catalytic converter হিসেবে ব্যবহৃত হয়ে থাকে, ক্ষতিকারক কার্বন মনোক্সাইড গ্যাসকে কার্বন ডাই-অক্সাইডে রুপান্তরিত করার জন্য। আবার অশোধিত তেল থেকে পরিশোধন করে প্রয়োজনীয় হাইড্রোকার্বন নিষ্কাশনের জন্য ল্যান্থানামের প্রয়োগ ব্যাপক।
কিছু বিরল ভূমিজ ধাতুকে বিদ্যুত-চুম্বকীয় বিকিরণ দিয়ে উদ্দীপিত করলে তারা আলো বিচ্ছুরিত করে। LED বাল্ব এবং compact fluorescent আলোতে এদের ব্যবহার করা হয়। ইউরোপিয়াম ফসফর রঙ্গিন টেলিভিসনে ষাটের দশক থেকে বযবহৃত হয়ে আসছে। নগণ্য মাত্রায় এরবিয়াম মিশ্রিত (doped) অ্যামপ্লিফায়ার ফাইবার-অপটিক তারে ব্যবহার করে দূরভাষ (long distance telephone) এবং তথ্য প্রেরণ (data transfer) ত্বরান্বিত করা হয়। ইট্রিয়াম-অ্যালুমিনিয়াম-গারনেট (YAG) একটি বহুব্যবহৃত লেজার মাধ্যম। এরবিয়াম এবং নিওডাইমিয়াম মিশ্রিত YAG লেজার এখন চিকিৎসা যন্ত্রে, উৎপাদন শিল্পে, প্রতিরক্ষা সরঞ্জাম ইত্যাদির জন্য একটি অতি প্রয়োজনীয় সামগ্রী।
এদের বৈদ্যুতিক গুণও উপযোগী। Nickel Metal-hydride (NiMH) ব্যাটারিতে সিরিয়াম, ল্যান্থানাম, নিওডাইমিয়াম ও প্রাসিওডাইমিয়ামের মিশ্রণ অ্যানোড হিসেবে ব্যবহৃত হয়। এর জন্য ধাতুগুলিকে পৃথকীকরণের প্রয়োজন নেই, কারণ মিশ্র ধাতু রূপেই এরা প্রাপ্য, তাই কিছুটা ব্যয় সাশ্রয়ী। এই অ্যানোডগুলিতে প্রতি ক্ষেত্রফলে বৈদ্যুতিক চার্জের ঘনত্ব খুব বেশি, তাই চার্জ ধরে রাখার ক্ষমতাও অনেক বেশি সময় স্থায়ী হয়। বৈদ্যুতিক যান এবং বহনযোগ্য যন্ত্রপাতিতে এই ব্যাটারি বহুব্যবহৃত।
এবং চৌম্বক তত্ত্ব
সব থেকে কার্যকারী বৈশিষ্ট্য এই ধাতুগুলির চৌম্বকীয় গুণ। এদের 4f-orbital-এ যে বেজোড় ইলেকট্রনরা থাকে, সমমুখী ঘূর্ণনের জন্য তাদের মধ্যে যথেষ্ট পরিমানে চৌম্বক শক্তি সঞ্চিত হয়। সাধারণ লৌহ পদার্থের চুম্বকের থেকে এদের চৌম্বক শক্তি অনেক গুণ বেশি। সাধারণ চুম্বকের তুলনায় নিওডাইমিয়াম চুম্বকের সঞ্চিত শক্তি প্রায় ১৮ গুণ বেশি। চৌম্বকীয় ক্ষেত্রের ক্ষমতা ১.২ টেসলাও ছাড়িয়ে যেতে পারে। অনেক কম ক্ষেত্রফলের ভেতরে তুলনামূলকভাবে এত অধিক শক্তি পাওয়া যায় বলে বিরল ধাতুর চুম্বকের আকারও সমশক্তির সাধারণ চুম্বকের থেকে বেশ ছোটো করা সম্ভব।
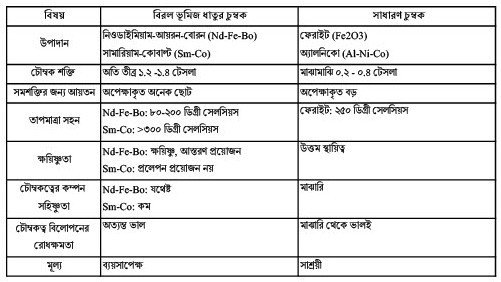
তবে বিশুদ্ধ ধাতু ঘরোয়া তাপমাত্রাতেই তার চৌম্বক ক্ষমতা হারিয়ে ফেলে। সেইজন্য অন্য ধাতুর সংকর ঘটিয়ে এই চুম্বকের স্থায়িত্ব অনেক গুণ বাড়াবার কৌশল মানুষ আয়ত্ব করেছে। প্রধানত দু’ ধরণের সংকর ধাতুর স্থায়ী চুম্বক ব্যাপকভাবে ব্যবহৃত হয়। একটি নিওডাইমিয়াম-আয়রন-বোরন (Nd2Fe14B) এবং অন্যটি সামারিয়াম-কোবাল্ট (SmCo5)।
নিওডাইমিয়াম-আয়রন-বোরন স্থায়ী চুম্বকদের মধ্যে সর্বাধিক শক্তিধারী। অত্যাধিক শক্তিশালী চৌম্বক ক্ষেত্র রচনা করতে পারে বলে যেখানে কম ক্ষেত্র পরিসরে অধিক চৌম্বকীয় বল প্রয়োজন, সে সব জায়গায় Nd2Fe14B চুম্বক উপয়ুক্ত। আকার হ্রস্ব এবং ওজনও কম। তবে এই চুম্বকগুলি সহজেই ভঙ্গুর এবং ক্ষয়িষ্ণু। তাই আয়ু বৃদ্ধির জন্য নিকেল, জিঙ্ক বা ইপক্সির আস্তরণ বা প্রলেপ প্রয়োজন হয়, তাতে চৌম্বক গুণ ক্ষতিগ্রস্ত হয় না। আর একটি সীমাবদ্ধতা হল, সাধারণ মানের নিওডাইমিয়াম চুম্বক মাত্র ৮০ ডিগ্রী থেকে ২০০ ডিগ্রী সেলসিয়াসের মধ্যেই চৌম্বকত্ব হারিয়ে ফেলে। তাপ সহিষ্ণুতা বাড়াবার উদ্দেশ্যে অন্য বিরল ভূমিজ ধাতু ডিসপ্রোসিয়াম (Dy) বা টেরবিয়াম (Tb)-এর মিশ্রণ আবশ্যক। বৈদ্যুতিক যান, বাতাস চালিত টারবাইন, কম্পিউটারের hard drive, হেডফোন, মাইক্রোফোন, অধিক ক্ষমতার শিল্পমানের মোটর, উপভোক্তা ইলেকট্রনিক দ্রব্য ইত্যাদিতে নিওডাইমিয়াম চুম্বকের ব্যবহার সুবিস্তৃত।
শক্তিমত্তার তুলনায় সামারিয়াম-কোবাল্ট চুম্বক দ্বিতীয় স্থানে হলেও যথেষ্ট বলশালী। এদের তাপ সহিষ্ণুতাও অধিকতর, ৩০০ ডিগ্রী সেলসিয়াস বা তারও বেশি। সাধারণ আবহাওয়ায় ক্ষয় হয় না বলে এই চুম্বকের কোন আস্তরণের প্রয়োজন হয় না। তবে ভঙ্গুরতা নিওডাইমিয়ামের থেকেও বেশি। কোবাল্ট সংমিশ্রণের কারণে তুলনামূলক হিসেবে অধিক ব্যয়সাপেক্ষ। বিমান বা মহাকাশযানে, প্রতিরক্ষা সামগ্রীতে, উচ্চতর তাপমাত্রা উৎপন্নকারী মোটরে, চিকিৎসা বিজ্ঞানে ব্যবহৃত যন্ত্রাদি যেমন MRI মেসিন ইত্যাদিতে, যেখানে প্রতিকুল পারিপার্শ্বিক আবহের মোকাবিলার ক্ষমতা প্রয়োজন, সেখানে সামারিয়াম-কোবাল্ট চুম্বকের ব্যবহার অনিবার্য।
এই দুই ধরনের চুম্বকই অধিক প্রচলিত। তবে এরা ছাড়াও প্রাসিওডাইমিয়াম, ডিসপ্রোসিয়াম ও হলোনিয়াম চুম্বও বাজারে পাওয়া যায়, লোহা ও বোরনের সংকর ধাতু রূপে।
বিভিন্ন আকৃতির বিরল ভূমিজ ধাতুর চুম্বক
বিরল ভূমিজ এবং সাধারণ চুম্বকের তুলনামূলক ছক
 ভারতের অবস্থান কোথায়?
ভারতের অবস্থান কোথায়?
সারা বিশ্বের উৎপাদনের নিরিখে একা চীনই ৭০ শতাংশ বিরল ভূমিজ ধাতু খনি থেকে আহরণ করে এবং ৯০ শতাংশ পরিশোধন করে উদ্ধার করে। অতএব আন্তর্জাতিক বাজারে তাদের নিয়ন্ত্রণ প্রায় একচ্ছত্র। সম্প্রতি বিস্ব বাণিজ্য প্রক্রিয়ায় যে অনিশ্চয়তা দেখা দিয়েছে, তার প্রেক্ষিতে চীন এই আকর, পরিশোধিত ধাতু ও মিশ্র ধাতু এবং উৎপাদিত সামগ্রীর রপ্তানিতে বিধিনিষেধ আরোপ করেছে।
অন্য দেশের মত ভারতেও তার পরিণাম গুরুত্বপূর্ণ। ভারতের খনিতে বিশ্বের প্রায় ৬ শতাংশ বিরল ধাতু মজুদ আছে। কিন্তু উৎপাদন মাত্র পৃথিবীর ১ শতাংশ। এই বছরেই ভারতের শুধু চুম্বক আমদানির অঙ্কই ৭০০ টনের কাছাকাছি হতে চলেছে। গত বছরে চুম্বকের সম্পূর্ণ আমদানিই প্রায় চীন থেকে হয়েছে। ২০২৩-২৪এ ভারত ১১৮৫ টন বিরল ভূমিজ ধাতু আমদানি করেছে। তার প্রায় ৭৮ শতাংশ চীন এবং তাদের শাসিত হংকং থেকে হয়েছে।
আমাদের দেশে কেরালা, ওড়িশা, অন্ধ্র ও তামিলনাড়ুতে বিরল ভূমিজের প্রপ্তি নির্ধারিত করা যায়। প্রধান খনিজ হ’ল মোনাজাইট বালু যা আসলে তেজস্ক্রিয় থোরিয়ামেরও উৎস। কেন্দ্রীয় সরকারের পারমাণবিক শক্তি মন্ত্রকের অধীনস্থ ইন্ডিয়ান রেয়ার আর্থস লিমিটেড (IREL) একমাত্র সংস্থা যারা দেশে এই ধাতু আহরণ এবং নিষ্কাশন করে থাকে। ২০২৩ সাল থেকে বিশাখাপত্তনমে তাদের নবনির্মিত কারখানায় সামারিয়াম-কোবাল্ট চুম্বক তৈরী শুরু হয়েছে। নতুন নীতি নির্ধারণ করে সরকার বেসরকারী উদ্যোগকেও উৎসাহিত করছে। এ ছাড়া আরও একটি গুরুত্বপূর্ণ পদক্ষেপ হ’ল নবগঠিত খনিজ বিদেশ ইন্ডিয়া লিমিটেড (KABIL), যারা লাতিন আমেরিকা ও আফ্রিকার দেশগুলিতে বিরল ভূমিজের খনি অন্বেষণ ও খনিজ নিষ্কাশনের কাজে বিশেষজ্ঞতা ও অর্থ বিনিয়োগের উদ্যোগ নিয়েছে।
এই নিবন্ধের সব উপাদান ইন্টারনেট থেকে সংগৃহীত। ঋণস্বীকার:
1) Science of Rare Earth Elements / Science History Institute / www. Sciencehistory.org
2) Rare Earth Elements – Metals, Definition, Properties, Uses / www.priyamstudycentre.com
3) The Rare Earth Question: What do the f-orbitals have to do with anything? – Ashley Driscoll / Ask the Science Posse / scienceposse.blogspot.com
4) byjus.com/chemistry/shell
5) From Dependency to Diplomacy: India’s Global Play For Rare Earths / Amit Kapoor & Anandita Doda / Institute for Competitiveness / competitiveness.in
6) Rare Earths Are New Assets: India to Become Credible Alternative In Critical Mineral Game / Times of India / Oct 21, 2025
7) What Makes Rare Earth Magnets Different from Regular Magnets / eclipsemagetics.com/resources
8) Rare Earth Elements Geochemistry and Geopolitics / Rosalie Tostevin / blogs.egu.eu

1 Comment